Rola witaminy D w prawidłowym funkcjonowaniu układu immunologicznego
Wpływ witaminy D na odporność wrodzoną (nieswoistą)
Witamina D działa na pierwszą linię obrony immunologicznej, wzmacniając barierę nabłonkową poprzez stymulację genów dla ścisłych połączeń komórkowych. Metabolit witaminy D – kalcytriol (1,25(OH)2D) wzmacnia funkcję bariery nabłonkowej rogówki [4] i jelit [5], a szczelny nabłonek stanowi przeszkodę dla patogenów. Ponadto, 1,25(OH)2D nasila produkcję peptydów przeciwdrobnoustrojowych (CAMP), takich jak katelicydyny i defensyny przez makrofagi i monocyty [6]. Są to białka znajdujące się na powierzchni nabłonka dróg oddechowych, przewodu pokarmowego, dróg moczowo-płciowych, które po wniknięciu do komórek bakterii lub wirusa dokonują rozpadu komórki. Jednocześnie uwrażliwiają one komórki immunokompetentne układu immunologicznego (makrofagi, komórki dendrytyczne) do generowania odporności komórkowej i humoralnej w odpowiedzi na obcy antygen, działają chemotaktycznie na neutrofile, monocyty, limfocyty T oraz neutralizują endotoksyny bakteryjne. Witamina D odgrywa ważną rolę w dojrzewaniu monocytów oraz wzmacnia potencjał chemotaktyczny i fagocytarny makrofagów. Wykazano, że niedobór witaminy D zaburza dojrzewanie monocytów przez zmniejszenie aktywności kwaśnej fosfatazy (enzymu lizosomalnego) oraz wydzielania H2O2, czynników niezbędnych do ich antybakteryjnej funkcji [7]. Wykazano, że leczenie 1,25(OH)2D było skuteczne w ograniczaniu infekcji dróg oddechowych u pacjentów z astmą dzięki zwiększonej ekspresji CAMP i modulacji cytokin zapalnych [8].Wpływ witaminy D na odporność nabytą (swoistą)
Odporność nabyta jest drugim stopniem obrony przed infekcją i jest odpowiedzialna za ukierunkowaną walkę z patogenami. W skład jej wchodzą komórki T i B, które są aktywowane po ekspozycji na patogeny, a dzięki pamięci immunologicznej, po poznaniu patogenu są w stanie odpowiednio wzmocnić odpowiedź [9]. Witamina D odgrywa istotną rolę w odpowiedzi swoistej organizmu. Bez obecności witaminy D, limfocyty Th nie są w stanie aktywnie rozpoznawać drobnoustrojów powodujących infekcje. Witamina D odpowiada za przejście limfocytów Th do aktywnej postaci. Limfocyty Th, po zetknięciu się z antygenem bakterii lub wirusa prezentowanym przez makrofagi lub komórki dendrytyczne, zaczynają się namnażać, powstaje kolonia kilkuset identycznych limfocytów Th, rozpoznających ten sam antygen drobnoustroju. Po namnożeniu limfocyty Th prezentują na swojej powierzchni receptor VDR. Po połączeniu z witaminą D limfocyty Th przechodzą szereg przemian, które pozwalają rozpocząć produkcję swoistych interleukin, które odpowiedzialne są za namnażanie limfocytów Tc i limfocytów B, będące głównym uderzeniem odpowiedzi swoistej, prowadzącym do eliminacji patogenów z organizmu człowieka [9]. Witamina D powoduje również uwrażliwienie komórek dendrytycznych, które są główną populacją komórek prezentujących antygen. Wykazują zdolność do immunoregulacji i immunotolerancji, inicjując odpowiedź immunologiczną limfocytów T w odpowiedzi na obce antygeny i komórki nowotworowe. Komórki dendrytyczne są populacją heterogenną, zdolną do stymulacji limfocytów T w kierunku różnicowania do limfocytów efektorowych, np. komórek pomocniczych CD4+(Th), cytotoksycznych CD8+(Tc).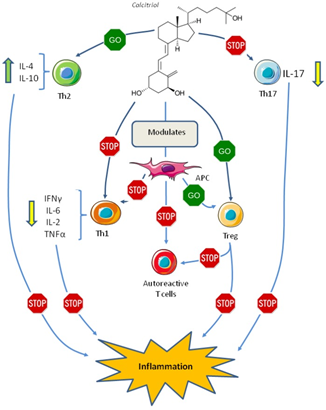
WITAMINA D I MIKROBIOTA: ZWIĘKSZANIE OBRONY GOSPODARZA
Witamina D jest odpowiedzialna za funkcję barierową nabłonka jelitowego i za modulację układu odpornościowego jelit, stąd jej niski poziom może wiązać się z większą przepuszczalnością jelit, a w konsekwencji z endotoksemią metaboliczną wywołaną przez mikrobiotę żyjącą w jelitach (GM), która może wywołać stan zapalny. Ponadto podawanie witaminy D może wpływać na skład GM, a badania in vitro pokazują, że witamina D wzmacnia zdolność bójcze makrofagów w stosunku do Escherichia coli. U zwierząt z niedoborem witaminy D i nokautem VDR, dysbioza GM sprzyja zaburzeniom metabolicznym. Inne badania na myszach wykazały, że ekspresja VDR zmniejsza odpowiedź na infekcję nabłonka jelit [9].Potwierdzenie skuteczności witaminy D w poprawie odporności
Witamina D może znaleźć zastosowanie również w prewencji wirusowych oraz bakteryjnych infekcji górnych dróg oddechowych, w tym grypy. Wykazano, że peptydy antybakteryjne (AMP), występujące w neutrofilach, monocytach, komórkach NK oraz w komórkach nabłonkowych wyściełających układ oddechowy ulegają zwiększonej ekspresji pod wpływem witaminy D [10]. Zakażenia pneumokokami, meningokokami oraz streptokokami grupy A występują najczęściej w okresie zimy, kiedy u ludzi obserwuje się najniższe stężenie witaminy D. Bakterie te są wrażliwe na AMP, co sugeruje, że farmakologiczne dawki witaminy D mogą się być pomocne w zapobieganiu oraz leczeniu tego typu infekcji [11, 12, 13]. W metaanalizie obejmującej 25 randomizowanych badań klinicznych (RCT) (11321 uczestników w wieku od 0 do 95 lat) wykazano, że podawanie codziennych lub cotygodniowych (nie bolusowych) dawek witaminy D zmniejszyło ryzyko ostrego zakażenia dróg oddechowych. Analiza podgrup wykazała, że codzienna lub tygodniowa suplementacja witaminy D chroniła przed ostrym zakażeniem dróg oddechowych, jednakże podawanie dużych dawek bolusowych nie wykazywało skuteczności. Najwyższą skuteczność odnotowano u osób, które miały na początku duży niedobór witaminy D, chociaż osoby z wyższymi wyjściowymi stężeniami 25(OH)D również odniosły korzyści [14]. Podawanie witaminy D poprawiło stan pacjentów zakażonych prątkiem gruźlicy. W RCT oceniono wpływ wysokich dawek (120 000 IU w ciągu 2 miesięcy, domięśniowo) witaminy D na stan pacjentów z gruźlicą. Po zastosowaniu witaminy D wykazano przyspieszoną poprawę pod względem klinicznym oraz radiologicznym u wszystkich pacjentów, ponadto wśród grupy chorych z bardzo niskim wyjściowym stężeniem 25(OH)D (<20 ng/mL) we krwi obserwowano zwiększoną indukcję odpowiedzi immunologicznej na prątki gruźlicy [15]. We wcześniejszych badaniach Martineau i wsp. oraz Wejse i wsp. nie wykazali różnic w obrazie klinicznym ani w śmiertelności po zastosowaniu witaminy D (odpowiednio 400 000 IU 25(OH)D oraz 300 000 IU) u chorych z gruźlicą płuc, jednakże może to być wynikiem zbyt małych dawek witaminy D, różnic w wariantach polimorfizmów genu VDR lub różnych wyjściowych stężeń 25(OH)D we krwi [14, 16]. Badanie pilotażowe z udziałem 76 pacjentów hospitalizowanych z powodu zakażenia COVID-19, wykazało, że podanie dużej dawki kalcyfediolu, głównego metabolitu witaminy D, znacznie zmniejszyło potrzebę leczenia na OIOM pacjentów wymagających hospitalizacji z powodu udowodnionego COVID-19 [17]. Witamina może być również skuteczna w zwiększaniu odporności na zakażenie HIV. Wykazano, że osoby seronegatywne narażone na zakażenie HIV wytwarzały więcej CAMP w błonie śluzowej jamy ustnej i w krwi obwodowej [18]. Niski poziom witaminy D w surowicy jest związany z progresją HIV/AIDS i śmiertelnością [19].Podsumowanie
Istnieje bardzo wiele przekonujących danych wskazujących, że witamina D odgrywa zasadniczą rolę w homeostazie układu odpornościowego oraz w zmniejszeniu ryzyka zakażeń, w tym SARS-COV-2, dlatego rutynowe przyjmowanie witaminy D w celu zapewnianie optymalnego zaopatrzenia organizmu wydaje się być wysoce zalecane.Piśmiennictwo
- Bikle D. J. Clin. Endocrinol. Metab., 2009; 94: 26-34.
- Baeke F, Korf H., Overbergh L, et al. J. Steroid Biochem Mol Biol, 2010; 121: 221-227.
- Myszka M, Klinger M. Postepy Hig Med Dosw (online), 2014; 68: 865-878
- Yin Z, Pintea V, Lin Y, et al. Invest Ophthalmol Vis Sci. 2011;52:7359–7364
- Pálmer HG, González-Sancho JM, Espada J, et al. J Cell Biol. 2001;154:369–387.
- Wei R, Christakos S. Nutrients. 2015; 24;7:8251-60.
- Sassi F, Tamone C, D’Amelio P. 2018;10:1656.
- Ramos-Martínez E, López-Vancell MR, Fernández de Córdova-Aguirre JC. Cytokine. 2018;108:239–246.
- Sassi F, Tamone C, D’Amelio P. Nutrients. 2018;10:1656.
- Aloia JF, Li-Ng M. Epidemiol Infect. 2007;135:1095-1096
- Dowell SF, Whitney CG, Wright C, Rose CEJr, et al. Emerg Infect Dis. 2003; 9: 573-579
- Jensen ES, Lundbye-Christensen S, Pedersen L, et al. Scand J Infect Dis. 2003; 35: 226-229
- Vlaminckx BJ, van Pelt W, Schouls LM, et al. Clin Microbiol Infect, 2005; 11: 226-231
- Martineau AR, Jolliffe DA, Richard HL et al. BMJ; 2017, 356:i6583
- Salahuddin N, Ali F, Hasan Z, et al. BMC Infect Dis, 2013; 13: 22
- Wejse C, Gomes VF, Rabna P, et al. Am J Respir Crit Care Med. 2009;1;179:843-50.
- Entrenas Castillo M, Entrenas Costa LM, Vaquero Barrios JM, et al. J Steroid Biochem Mol Biol. 2020;203:105751.
- Aguilar-Jimenez W, Zapata W, Rugeles MT. Microbes Infect. 2016;18:510–516.
- Coussens AK, Naude CE, Goliath R, et al. PNAS. 2015;112:8052–8057.
Nota biograficzna

Posiada 20-letnie doświadczenie w zakresie badań fitochemicznych i biologicznych oraz informacji naukowej (adiunkt w Katedrze i Zakładzie Farmakognozji Uniwersytetu Medycznego w Poznaniu). Autorka prac eksperymentalnych i poglądowych z zakresu izolacji i identyfikacji związków pochodzenia roślinnego oraz oceny ich aktywności biologicznej. Od 2015 roku prowadzi zajęcia na studiach podyplomowych „Zioła w praktyce i terapii”.
Obecnie pracuje w CHC w Pionie R&D, Dziale Regulacji. Odpowiada m.in. za opracowanie raportów Eksperta (raport kliniczny, nieklinicznych) dla produktów leczniczych, raportu klinicznego do zmian kategorii dostępności produktu leczniczego (switch OTC), oceny klinicznej dla wyrobów medycznych oraz prowadzenie działań w obszarze nadzoru nad bezpieczeństwem wyrobów medycznych, a także za ocenę bezpieczeństwa surowców roślinnych stosowanych w produktach leczniczych, wyrobach medycznych i suplementach diety.
tel.: 61 625 27 00
fax: 61 625 27 01
office@chc.com.pl
bd@chc.com.pl
purchasing@chc.com.pl
rd@chc.com.pl
BDO: 000102401
Wysogotowo
ul. Batorowska 52
62-081 Przeźmierowo
Sąd Rejonowy Poznań-Nowe Miasto
i Wilda w Poznaniu, VIII Wydział Gospodarczy
KRS 0000871229, NIP 781-00-41-371
kapitał zakładowy: 36 100 000 PLN
© Curtis Health Caps. All rights reserved.